normalité chimie vs molarité
La molarité et la normalité sont deux phénomènes importants et couramment utilisés en chimie. Les deux termes sont utilisés pour indiquer une mesure quantitative d'une substance. Si vous souhaitez déterminer la quantité d’ions de cuivre dans une solution, vous pouvez l’indiquer comme mesure de la concentration. La plupart des calculs chimiques utilisent des mesures de concentration pour tirer des conclusions sur le mélange. Pour déterminer la concentration, nous devons avoir un mélange de composants. Pour calculer la concentration de chaque composant, les quantités relatives dissoutes dans la solution doivent être connues. La concentration est un terme plus large utilisé, et molarité et normalité sont des types de mesure de concentration.
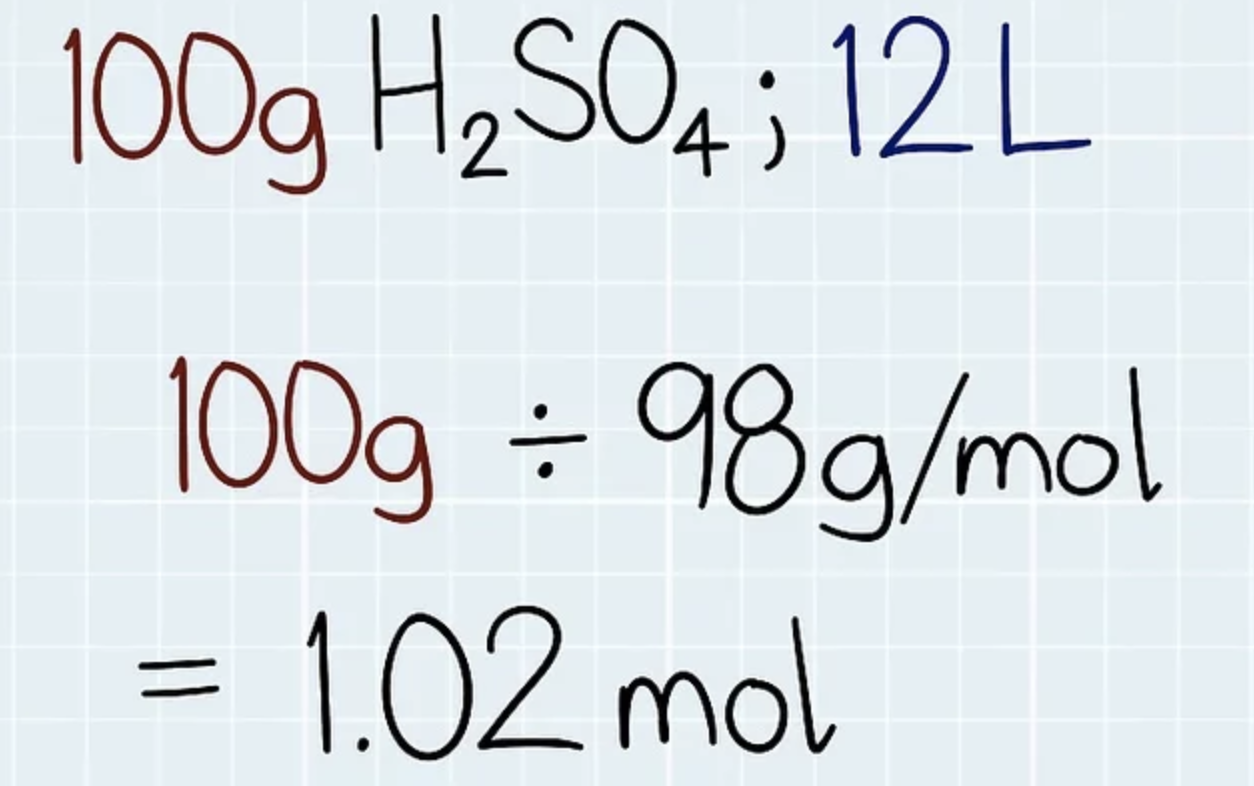
Comme indiqué ci-dessus, la normalité est un autre moyen d'indiquer la concentration. "N" est le symbole utilisé pour désigner la normalité. La normalité est donnée en équivalent par litre. Un équivalent est le nombre de moles d'unités réactives dans un composé. Eq / L et mol / L sont les unités utilisées pour indiquer la normalité. Par exemple, une mole de chlorure d'hydrogène donne une mole d'ions hydrogène et une mole d'ions chlorure à la solution. Une mole d'ions hydrogène est égale à un équivalent d'ions hydrogène. Par conséquent, 1 M HCl est identique à 1 N HCL, mais lorsque nous prenons de l'acide sulfurique, 1 mole d'acide sulfurique donne 2 moles d'ions hydrogène dans la solution. Par conséquent, la normalité des ions hydrogène sera 2N pour une solution d'acide sulfurique. Pour mieux comprendre la normalité, prenons une solution de chlorure de calcium. Pour les ions chlorure, la normalité est de 2 N car une mole de chlorure de calcium donne deux moles d'ions chlorure. Pour le calcium, la valence est +2. Donc, c'est comme si le calcium pouvait remplacer deux ions d'hydrogène. Par conséquent, sa normalité est également 2.
La molarité est également appelée concentration molaire. C'est le rapport entre le nombre de moles d'une substance dans un volume de solvant. Classiquement, le volume de solvant est donné en mètres cubes. Cependant, pour notre commodité, nous utilisons souvent des litres ou des décimètres cubes. Par conséquent, l’unité de la molarité est mole par litre / décimètre cube (mole l-1, mol dm-3). L'unité est également indiquée par M. Par exemple, une solution de 1 mol de chlorure de sodium en solution dans l'eau a une molarité de 1 M. La molarité est la méthode de concentration la plus utilisée. Par exemple, il est utilisé dans le calcul du pH, des constantes de dissociation / d'équilibre, etc. La conversion d'une masse d'un soluté donné en son nombre molaire doit être effectuée afin de donner la concentration molaire est divisé par le poids moléculaire du soluté. Par exemple, si vous souhaitez préparer une solution de sulfate de potassium à 1 M, 174,26 g mol-1 (1 mol) de sulfate de potassium doit être dissous dans un litre d'eau.




